Por que genes imunitários que nos prejudicam persistem?
Um aparente paradoxo em relação aos nossos sistemas imunológicos está ligado a incrível diversidade genética exibida pelos loci do complexo principal de histocompatibilidade (MHC) dos vertebrados que acaba por influenciar nossa susceptibilidade a uma série de doenças infecciosas e autoimunes. Desta forma este sistema de receptores de

membranas associado ao reconhecimento de antígeno, e intercomunicação entre as células imunológicas, que nos protege de infecções também nos torna suscetível a outras e mesmo a doenças autoimunes. Várias explicações evolutivas para a manutenção destes polimorfismos existem, mas há ainda bastante controvérsia sobre elas, como lembram os autores de recente artigo publicado no PNAS.
A principal explicação envolve a coevolução antagônica (a conhecida “Rainha Vermelha”), uma forma de corrida armamentista coevolutiva entre hospedeiros e patógenos, ao nível molecular, na qual patógenos evoluem para escapar do reconhecimento imunológico através das variantes (alelos) mais comuns do MHC, ao mesmo tempo que favorecem os hospedeiros que possuam variantes mais raras de alelos do MHC para as quais os patógenos não estão adaptados não sendo capazes de evadir dos seu reconhecimento, fazendo com que os indivíduos que portam essas variantes raras aumentem sua frequência na população, o, por sua vez, gera uma pressão de seleção que favorece os patógenos que conseguem evadir estes, antes raros, alelos dando origem, assim, a um grande processo de 'toma lá da cá" evolutivo, em que a vantagem é sempre dependente de frequência e por isso está sempre mudando.
Este processo cíclico pode promover a diversidade do MHC somente se duas condições forem atendidas: (i) a adaptação do patógeno deve produzir custos (‘trade-offs’) que fazem com a aptidão dos patógenos seja maior em hospedeiros familiares (i.e. com aos quais estão em contato e portanto, adaptando-se ao seu MHC) e menor em relação aos genótipos de hospedeiro aos quais os patógenos não tiveram contato, não podendo adaptaram-se as suas variantes do MHC; e (ii) esta adaptação deve produzir padrões correlacionados de virulência, ou seja, de gravidade da doença.
O trabalho em questão testou essas pressuposições fundamentais, utilizando uma abordagem experimental evolutiva (passagem em série) e foi capaz de documentar uma rápida adaptação e evolução da virulência de um retrovírus específico de camundongos, em relação ao seu hospedeiro mamífero, em uma variedade de genótipos do MHC. O ponto principal é que essa resposta adaptativa resultou em ‘trade-offs’ (ou seja, 'pleiotropia antagônica') entre genótipos do MHC de diferentes hospedeiros, com, tanto aptidão viral como a virulência, sendo substancialmente maior em hospedeiros que exibiam variantes do MHC familiares quando comparas as em hospedeiros com genótipos do MHC desconhecidos.
O experimento foi feito da seguinte maneira: Foram utilizados sessenta camundongos isogênicos, isto é geneticamente idênticos, exceto por que cada grupo de 20 portava uma variedade diferente de genes do MHC, conhecidos, respectivamente, como b, d, k. Cada um dos três grupos de camundongos foram infectados por um retrovírus causador de leucemia chamado de Friend que havia sido replicado em cultura de tecidos. Era permitido ao vírus se multiplicar nos camundongos por 12 dias, invadindo os tecidos como baço e fígado, com o número de partículas virais sendo medido a partir de amostras do baço e a severidade da infecção medida através da pesagem do baço aumentado.
Os vírus eram então retirados de cada um dos primeiros três pares de camundongos (b, d, k) e, sendo utilizados para infectar outros três pares com os mesmos tipos de variantes de MHC, com o processo sendo repetido em 10 pares de animais, cada um com um tipo distinto de MHC, dando tempo para que o vírus pudesse mutar.
Os cientistas, nesta primeira fase do estudo, conseguiram mostrar que o vírus Friend era capaz de se adaptar, evadindo as variantes MHC (b, d ou k) expressas pelas células dos camundongos infectados. Em uma fase posterior da pesquisa, através de um segundo experimento, os investigadores demonstraram que o vírus conseguia se adaptar somente as proteínas específicas do MHC dos camundongos nos quais foram introduzidos. Assim, os vírus que adaptaram-se aos (e causaram o adoecimento dos) camundongos com a variante da proteína do MHC do tipo b, eram eficazmente reconhecidos e repelidos em animais com os tipos d e k.
Na terceira fase, em um terceiro experimento, os investigadores demonstraram que a aptidão do patógeno (medido pelo número de partículas de vírus no baço) correlacionava-se com a virulência do patógeno (estabelecido pelo aumento do baço, aferido através de seu peso), mostrando que os vírus capazes de evadir um certo tipo de MHC tornavam os camundongos com este mesmo tipo mais doentes.
Em trechos de uma entrevista divulgada no site da Universidade de Utah, um dos autores do estudo Wayne K. Potts afirma que os resultados têm algumas implicações importantes:
“Em conjunto, as experimentos demonstram "o primeiro passo na dança antagônica co-evolutiva" entre um vírus e genes do MHC”
O autor sinaliza algumas áreas e questões nas quais este conhecimento pode ser bastante útil:
O uso de antibióticos para aumentar a produtividade em rebanhos leiteiros e em outros animais é um dos principais motivos para a cada vez mais resistência aos antibióticos por parte dos microrganismos causadores de doenças humana e, isso é agravado pelo cruzamento seletivos de animais em favor da maior produção leite e carne que acabou por reduzir diversidade genética na pecuária, incluindo em relação ao MHC. Isso poderia ser remedia pela introdução de maior variabilidade genética com o retrocruzamento dos rebanhos, o que poderia aumentar a resistência a doenças e, desta maneira reduzir a necessidade de antibióticos.
Como as populações de espécies ameaçadas são bastante reduzidas, tendo portanto menos diversidade genética, elas acabam por tornar-se um alvo fácil para os germes. Por isso Potts argumenta que seria desejável também reintroduzir mais variação genética nessas espécies ameaçadas de extinção através de programas de manejo reprodutivo a fim de reforçar sua capacidade de resposta imune.
Como a variação genética do MHC em pessoas e outros organismos é importante para limitar a evolução e a propagação de doenças emergentes. Agora a partir deste trabalho Potts e seus colegas criaram basicamente um modelo experimental de acompanhamento de doenças emergentes, fazendo com que um vírus evoluíssem em camundongos.
"É um modelo para identificar o que as coisas mudam em vírus para torná-los mais virulenta e, portanto, uma doença emergente."
Segundo os autores, estes dados são únicos já que confirmam experimentalmente pela primeira vez as condições necessárias do modelo de coevolução antagônica da evolução do MHC, fornecendo a quantificação dos efeitos da aptidão do patógeno e do hospedeiro. Por fim, estes resultados ajudam a explicar a diversidade sem precedentes de genes do MHC, incluindo como as variantes causadoras de doenças seriam mantidas.
_________________________________________
Referências:
Kubinak, Jason L., Ruff, James S., Hyzer, Cornelius Whitney, Slev, Patricia R. and Potts, Wayne K.. Experimental viral evolution to specific host MHC genotypes reveals fitness and virulence trade-offs in alternative MHC types. Proceedings of the National Academy of Sciences, 2012 DOI: 10.1073/pnas.1112633109
University of Utah (2012, February 7). Why bad immunity genes survive: Study implicates arms race between genes and germs. University of Utah News Center. Acessado em 8 de fevereiro de 2012.]
Credit: PETER GARDINER/SCIENCE PHOTO LIBRARY
Credit: PETER GARDINER/SCIENCE PHOTO LIBRARY
Credit: LAGUNA DESIGN/SCIENCE PHOTO LIBRARY]
Credit: GEORGE STEINMETZ/SCIENCE PHOTO LIBRARY
____________________________________________________
Nota [1]:
O que é o MHC, afinal?
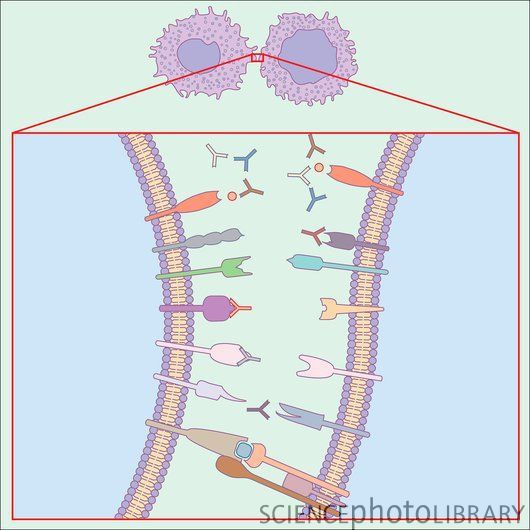
O MHC - do inglês “Major Histocompatibility Complex” ('Complexo Principal de Histocompatibilidade') - compreende uma região genômica que se estende por cerca de 4 milhões de pares de bases (podendo, de acordo com algumas estimativas, chegar a 7 Mpb) em que concentram-se um grande agregado de loci (de acordo com algumas estimativas, mais de 200 genes), em sua maioria, associados ao sistema imune que normalmente é dividido em três tipos, MHC de classe I, II e III, com as classes I e II estando diretamente envolvidos na resposta imunológica e em processos autoimunes, assim como alguns dos loci da classe III que estão associados ao sistema complemento. Grande parte desses desses loci codificam glicoproteínas de membrana que são expressas na superfície de todas as células do corpo, com algumas classes, como II, sendo expressas exclusivamente em células brancas, como fagócitos. É através dessas proteínas de membrana que s é mediada a rejeição de transplantes alógrafos. Tanto é assim que as classes I e II do MHC, em seres humanos, são conhecidas também pela sigla HLA, do inglês “Human Leukocyte Antigens” ('Antígenos leucocitários humanos') já que definem o tipo específico de tecidos do indivíduos e, por isso, precisam ser tipadas durante o processo de verificação da compatibilidade entre doadores e receptores de órgãos.
Mas a principal função do MHC - cujo caráter fisiológico adaptativo é o mais óbvio - é a apresentação de antígenos que é feita através da co-expressão de moléculas do MHC com fragmentos proteicos processados que podem ser oriundos de células infectadas por vírus, células tumorais e de células que fagocitaram microrganismos. Os peptídeos apresentados através do MHC interagem com receptores específicos das células T 'assassinas' e 'ajudantes'. No caso dos antígenos apresentados por proteínas do MHC de classe I, as células que exibirem antígenos não familiares, ao interagirem com os linfócitos T 'assassinos' (como fragmentos de proteínas virais, por exemplo) serão atacadas e destruídas pelo sistema imunológico. Já as células fagocíticas, as únicas a expressarem proteínas derivadas dos genes do MHC da classe II, que tiverem fagocitado bactérias serão ativadas dando conta de maneira mais eficiente dos microrganismos. Por outro lado, caso as células deste tipo apresentarem, complexadas ao MHC, antígenos do próprio corpo normais, estas células serão estimuladas a cometerem apoptose ao interagirem com linfócitos T ajudantes, de modo que respostas imunológica à moléculas normais do próprio organismos sejam inibidas. Através desse processo nossos sistemas imunológico reconhecem os antígenos autóctones de células saudáveis, que os pesquisadores às vezes chamam de 'próprios' (‘self’), e os diferencia dos estranhos e de origem patológica, os 'não-próprios' (‘non-self’). É desta maneira que o MHC é um dos principais componentes desta rede de estabelecimento e manutenção da identidade molecular que é o sistema imunológico. Porém nem sempre as coisas funcionam a contento.
O MHC exibe um alto nível de polimorfismo, sendo até 100 vezes maior do que a média do genoma humano, com muitas das variantes parecendo estar ligadas a suscetibilidade aumentada ou diminuída a uma vasta gama de doenças como a malária, hanseníase, febre tifoide, infecção por HIV e pelos vírus da hepatites etc.
Literatura Recomendada:
Janeway CA Jr, Travers P, Walport M, et al. Immunobiology: The Immune System in Health and Disease. 5th edition. New York: Garland Science; 2001.
Twyman, Richard The major histocompatibility complex [Publicado on line em 30/7/03] The Human Genome: Welcome trust; 2003.
Powis SH, Geraghty DE. What is the MHC? Immunol Today. 1995 Oct;16(10):466-8. PubMed PMID: 7576048.
