Quando a galinha torce o hallux!
Quando pensamos na evolução das inovações das morfologias dos organismos multicelulares, como plantas, animais e fungos, muitos de nós talvez tenhamos a tendência de nos concentrar apenas nas mutações, ou seja, em alterações do DNA que modificam as sequências codificadoras de genes específicos ou as sequências regulatórias que controlam o seu padrão de expressão. Porém, como já comentei em outras oportunidades, essa é apenas uma parte da história ['É a evolução genética previsível? Parte I', 'É a evolução genética previsível? Parte II ou Além da genética parte I', 'De determinantes 'genéricos' aos 'genéticos': A importância da física nos primódios da evolução animal.', 'Viva Turing de novo, mais pistas sobre a evolução dos membros em vertebrados']. A mera mudança de um ou mesmo de vários genes (ou do seus padrões expressão) não explica completamente como as inovações morfológicas surgem. Para entender realmente como isso acontece precisamos compreender como essas mudanças afetam o desenvolvimento dos organismos, especialmente seu desenvolvimento embrionário.
Por exemplo, as mutações podem simplesmente modificar a forma como as células comunicam-se umas com as outras, o que pode acontecer por intermédio de alterações dos sinais químicos que as células trocam entre si. Alguns desses sinais químicos, como as secreções hormonais, agem a longas distâncias de onde são produzidos, outros, como as secreções parácrinas, atuam nas células vizinhas e outras, como as autócrinas, atuam nas próprias células secretoras. Esses tipos de interação podem por sua vez produzir gradientes químicos e criar 'loops' ou alças de retroalimentação positiva ou negativa que, basicamente, são formas de, respectivamente, amplificar ou autolimitar esses sinais e, desta maneira, controlar os processos desencadeados por eles. Em outras situações, mutações mudam o jeito como as células 'interpretam' esses sinais ao alterarem proteínas receptores (de membrana, nucleares ou citoplasmáticas) ou as proteínas que participam das cascatas de transdução de sinal. Essas mutações, portanto, alteram como as redes de interações entre as proteínas, seus produtos diretos e os genes funcionam, podendo promover mudanças metabólicas, no estado de ativação das proteínas e nos padrões de transcrição dos genes. Por fim, outros tipos de mutações podem alterar as propriedades e o arranjo do citoesqueleto ou das proteína que funcionam como junções entre as células imediatamente mais próximas e entre as células e a matriz extra-celular, onde elas estão inseridas. Essas últimas alterações podem produzir mudanças no balanço das forças mecânicas e induzir deslocamentos, adelgaçamentos, dobras e outras modificações nas formas dos tecidos.
No que refere-se a evolução morfológica, o que as mutações faze, portanto, é mudar a forma como as células, tecidos e o embrião, como um todo, comportam-se. Isso pode ser o resultado de alterações nas taxas de proliferação (ou de morte celular programada), na direção e velocidade de movimento e no tipo e intensidade das forças de adesão entre elas. Então, são essas mudanças ao nível celular e tecidual que, ao alterarem a dinâmica e a intensidade das forças físicas e das interações químicas entre as células (e os tecidos e a matriz extracelular) é que acabam dando origem a novas morfologias, que emergem ao longo da evolução. Uma vez que nos damos conta de todas essas complexas cadeias causais de eventos e dessas relações espaciais e temporais, percebemos que o papel dos genes pode ser bastante indireto e por isso facilmente nos escapar. É exatamente isso que mostra um trabalho do pesquisador brasileiro João Francisco Botelho, da Universidade do Chile, realizado em colaboração com outros cientistas, que foi publicado na revista Science Reports [1]. O artigo mostra como uma característica morfológica muito importante das aves – que inclusive as diferenciam dos seus parentes dinossauros terópodes já extintos – depende, para que seja produzida durante o desenvolvimento, da atividade da musculatura embrionária e sugere como essa peculiaridade pode ter resultado em sua evolução [1, 2].
As aves atualmente existentes possuem um dedo opositor (dedo 1 ou D1), o hálux, em suas patas. Esta estrutura é considerada uma importante inovação evolutiva em comparação ao que podemos observar nos fósseis de formas ancestrais, ou seja, nos dinossauros terópodes não-avianos. A configuração deste dedo permite às aves agarrarem e empoleirarem-se com suas patas. Em contrastaste, nos dinossauros terópodes não-avianos o dedo equivalente em suas patas posteriores é bem menor e não oponível. Na verdade, este dedo, nos dinossauros, nem ao menos toca o chão, parecendo mais os dedos extras (ou 'dewclaws') presentes nos cães e gatos [veja a figura ao lado e abaixo] [2]. Porém, o desenvolvimento embrionário das aves nos fornece algumas pistas da história evolutiva desta estrutura.
Como explicam Botelho e colaboradores [1], as patas traseiras dos primeiros dinossauros, como o Herrerassauro, exibiam uma configuração diferente, com quatro dígitos funcionais; todos eles articulam-se com o tornozelo (tarso), como mostra a figura abaixo (1a) retirada do artigo da Science Reports. Porém, já a partir de dinossauros tetanuranos (um subgrupo dos dinossauros terópodes) primitivos, como os Alossauro, e até em seus descendentes modernos, as aves, o hallux não articula-se com o tarso, mas com o seu metatarso (Mt1), que sofreu um afilamento proximal na forma de lágrima que cria uma articulação sinovial que não é rígida com metatarso 2 (Mt2), como mostrado em 1b. Porém, diferentemente do que vemos nas aves modernas, nos primeiros tetanuranos, o primeiro dedo (D1) não é um digito opositor (fig. 1b, c). As aves, entretanto, logo no começo de sua evolução, evoluíram um configuração diferente do hálux, que nelas passou a opor-se aos outros dedos, como vemos em 1d. Porém, talvez o mais interessante é que ao observamos o desenvolvimento embrionário das aves, conseguimos vislumbrar parcialmente esta transição [1].
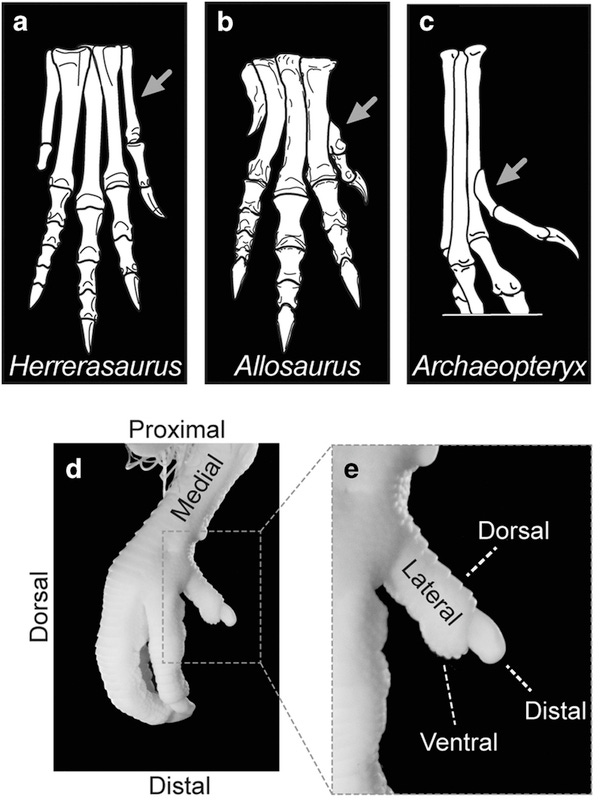
Nos embriões das aves, o D1 começa seu desenvolvimento de maneira bem similar ao padrão encontrado nos fósseis dos dinossauros terópodes [2]. Mas logo em seguida, a sua base, o metatarso, sofre uma torção e é isso que faz com que ele assuma sua configuração opositora. Botelho já havia observado que essa torção ocorria logo após a musculatura embrionária do D1 estabelecer-se em seu local [2]. Além disso, os pesquisadores também sabiam que o início do movimento do dedo do pé coincidia com a torção da sua base [2].
Os pesquisadores mostraram também que os genes responsáveis pela maturação do tecido cartilaginoso eram expressos em um estágio muito mais tardio do que ocorria nos outros dedos [1, 2]. Isso significa que ele mantém muitas células-tronco que dividem-se rapidamente e continuam fazendo isso por um período muito mais longo do que ocorre nos outros dedos [2]. Como este tecido cartilaginoso imaturo é muito plástico, ele pode facilmente ser deformado ou transformado pela atividade muscular. Para confirmar isso, Botelho e seus colaboradores decidiram bloquear a atividade muscular logo antes que a torção do dedo começasse no embrião. Ao utilizar nesses embriões em desenvolvimento o agente farmacológico brometo de decametónio, que tem um efeito paralisante sobre a musculatura embrionária, Botelho conseguiu produzir dedos não oponíveis, com uma base linear, não era torcida, portanto, idêntica ao observado nos dinossauros terópodes, ou seja, que, como eles colocam, 'fenocopiava' a morfologia dos dinossauros terópodes tetanuranos mais antigos. [1]

Porém, esse não é só mais um experimento que consegue reconstituir morfologias ancestrais. Como explica o biólogo Gunher Wagner, pesquisador de biologia evolutiva do desenvolvimento e genética evolutiva da Universidade de Yale, no EUA:
"Este é um dos exemplos mais claros do quão indiretamente as consequências morfológicas da alteração genética são mediadas" [2]
Este estudo investiga uma "verdadeira mecânica do desenvolvimento" [2], como descreve Wagner e acrescenta:
“Os experimentos provam que interações ao nível dos sistemas de órgãos canalizam os rumos da evolução dos organismos."[2]
Os resultados das pesquisa de Botelho e seus colaboradores mostram que a diferenciação do hálux nas aves modernas segue um padrão único em que a diferenciação progride da região proximal para a distal. Lembre-se também que os marcadores moleculares, usados para identificar a maturação cartilagem e ossificação, mostram que a diferenciação deste dedo (Mt1) é significativamente atrasada em comparação ao que acontece com os demais dedos (Mt2-4) [1]. Estas constatações levaram os pesquisadores a sugerir que seria exatamente essa maturação tardia, ao manter o tecido plastico por mais tempo, que teria facilitando a torção proveniente da atividade muscular subsequente. Como explicam os autores do trabalho:
"Em formas intermédias entre arqueópterix e as aves modernas, a extremidade proximal do Mt1 não é torcida, mas a extremidade distal é notavelmente deslocada. O novo contexto de dados desenvolvimentais sugere que a atividade muscular nestes primeiros Pygostylia poderia ter encontrado uma extremidade proximal já diferenciada, mas ainda imatura, uma epífise distal mais plástica, levando à característica forma em J do seu Mt1 (fig. 7). A hipótese de que sucessivos atrasos na maturação permitiu a torção progressiva do Mt1 é consistente com o fato de que as aves se tornaram cada vez mais pedomórficas em comparação aos seus ancestrais dinossauros e que os embriões de Maniraptores tronco fósseis - incluindo Enantiornithes – diferiam das aves atuais pelo fato de que eclodirem com metatarsos, metacarpos e falanges quase totalmente ossificadas, 39, 40, 41, 42, 43. Em um cenário alternativo, a motilidade embrionárias pode iniciar mais cedo ou tornar-se mais intensa nas aves modernas do que em seus antepassados, antecipando e/ou ampliando a influência dos músculos no desenvolvimento da Mt1. Interessantemente, demonstrou-se que o metabolismo e a taxa de crescimento dos ossos são correlacionados, e que o metabolismo elevado nas Aves depende do aumento de massa muscular para gerar calor, tornando possível que tanto o aumento da atividade muscular e as alterações no desenvolvimento do esqueleto sejam fisiológica e evolutivamente relacionadas uma com a outra através do aumento do metabolismo aviário. O papel da musculatura embrionária também fornece uma explicação para aquisição secundária de Mt1 reto, não torcido, em pinguins e petréis: Estes são grupos derivados entre as aves modernas nos quais os músculos FHL e EHL estão ausentes (SI, S2 fig.)." [1]

Na figura acima vemos as patas de Qiliania, uma ave primitiva de cauda curta, que exibia padrões intermediários de configuração do Mt1. Nela o Mt1 tem uma extremidade proximal não torcida, mas já possui um desvio ("dobra") na extremidade distal, como indicado pela seta. Como o Mt1 das aves modernas amadurece no sentido proximal para o distal, ou seja, da base para a extremidade, os pesquisadores fizeram três sugestões [1]:
Nas aves não-Pygostylianas, o Mt1 teria amadurecido antes do início da atividade muscular;
Nas aves Pygostylia a maturação teria sido adiada, permitindo a flexão distal do Mt1 provocada pela atividade muscular embrionária;
Em Ornithuromorpha teria havido um atraso ainda maior na maturação do Mt1, o que teria permitido a torção completa do seu eixo longo pela atividade muscular embrionária.
Desta maneira, as mutações originais talvez não tivessem provocado diretamente nenhum tipo de alteração morfológica mais conspícua, apenas teriam deixado o tecido mais plástico, mais 'maleável', e principalmente, isso teria ocorrido por um tempo maior, de modo a expô-lo a atividade muscular que só inicia-se posteriormente. Isto é, a mera modificação no 'timing' do enrijecimento do tecido teria propiciado um novo tipo de interação ao expô-lo a um microambiente epigenético diferente, onde forças distintas atuariam; e, dado sua maior maleabilidade, levaria a emergência da nova configuração, pelo menos, nas fases iniciais do processo de evolução.
Este belo e elegante estudo mostra a importância de conhecermos bem os mecanismos e processos pelos quais os seres vivos se constroem. Devemos investigar com maior profundidade não só o que acontece com os genes, sequência regulatórias e seus produtos mais diretos, como RNAs e proteínas, mas precisamos também explorar como esses eventos afetam (e são afetados por) os processos celulares, teciduais e embriológicos, mesmo ao nível de sistemas de órgãos já mais diferenciados, que estão por trás da origem da forma biológica. Isto significa que precisamos compreender muito melhor os mecanismos físicos, químicos e geométricos de 'formação de padrão' dos seres vivos, especialmente dos multicelulares complexos, e integrar esses conhecimentos a enorme gama de informação que dispomos atualmente e que são oriundas da genética e da biologia molecular e dos seus desdobramentos, como a bioinformática, genômica, proteômica etc.
---------------------------------
Referências:
Francisco Botelho, J., Smith-Paredes, Daniel, Soto-Acuña, Sergio, Mpodozis, Jorge, Palma, Verónica & Vargas, Alexander O. Skeletal plasticity in response to embryonic muscular activity underlies the development and evolution of the perching digit of birds. Sci. Rep. 5, 9840; 2015 doi: 10.1038/srep09840
Universidad de Chile. "From chicken to dinosaur: Scientists experimentally 'reverse evolution' of perching toe." Alphagalileo.org, 22 May 2015.
Créditos das Figuras:
Uma ave empoleirada em um galho: TONY CAMACHO/SCIENCE PHOTO LIBRARY
O dedo de empoleira-se das galinhas: Fonte.
Dewclaw: Fonte
Demais figuras: doi: 10.1038/srep09840
